Além da água e do gás carbônico (CA-5), outros gases presentes na atmosfera em quantidade traço absorvem radiação térmica, contribuindo para o efeito estufa. Nessa atividade de estudo procuraremos fornecer dados para uma discussão sobre a importância desses gases no efeito estufa, e as principais fontes de produção desses poluentes.
Os principais gases traço analisados nessa atividade são: monóxido de carbono (CO), CFCs, metano (CH4), dióxido de nitrogênio (NO2), óxido nitroso (N2O), ozônio (O3) e dióxido de enxofre (SO2).
Na atividade CA-5 você já analisou e determinou a faixa de absorção em que água e o gás carbônico (dióxido de carbono) absorvem radiação. Na figura abaixo está representada a radiação térmica (radiação no infravermelho) da Terra em função do comprimento de onda, e a região do espectro onde o vapor de água e o gás carbônico absorvem.
Você pode representar as regiões
no espectro térmico da Terra em que os demais gases traço
absorvem. Para isso analise os gráfico de absorção
dos gases em função do comprimento de onda, apresentado abaixo.
Você pode se basear na análise já feita para a água
(H2O) e o gás carbônico (CO2). Considere
que os CFCs absorvem na faixa entre 8-12 m (na verdade existem pequenas
diferenças na faixa de absorção de cada CFC, estamos
considerando aqui a faixa que abrange os principais CFCs encontrados na
atmosfera). Na verdade, os CFCs participam também de outro processo
de alteração da atmosfera,
a destruição da camada de ozônio (CA-9).
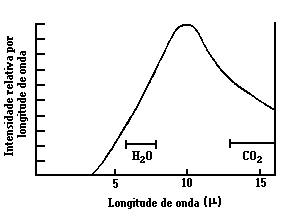
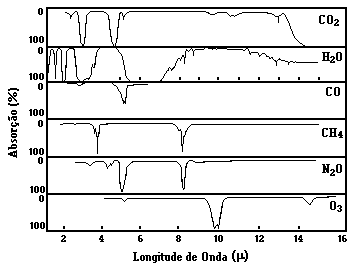
Após essa análise você vai perceber que a janela ótica está muito menor, isso significa que os gases traço da atmosfera estão absorvendo grande parte da energia infravermelha, e consequentemente está ocorrendo um maior aquecimento global.
Entretanto, para determinarmos se um gás contribui significativamente para o efeito estufa precisamos analisar outros fatores além da sua região de absorção no infravermelho. Você seria capaz de imaginar quais outros fatores devem ser considerados para determinar a influência de um gás no efeito estufa?
O tempo de vida dos gases na atmosfera é
um dado importante para avaliarmos seu efeito no aumento da temperatura
global. Na tabela abaixo estão tabelados os tempos de vida dos gases
traço na atmosfera. Analise e compare os valores do tempo de vida
para os gases.
| Gás | Tempo de vida |
| Gás Carbônico | 50-200 anos |
| Metano | 10 anos |
| CFC-11* | 65 anos |
| CFC-12* | 130 anos |
| Óxido Nitroso | 150 anos |
| Dióxido de Nitrogênio | 1 dia |
| Dióxido de Enxofre | Poucas semanas |
A seguir são apresentados dados tabelados sobre as principais fontes de liberação na atmosfera dos gases traço: monóxido de carbono, metano e óxido nitroso. Esses dados permitem uma avaliação da quantidade desses gases na atmosfera e uma discussão sobre as suas fontes. É importante que você (ou seus alunos) saiba distingüir entre as fontes naturais e as antropogênicas. Procure estimar a porcentagem dos gases na atmosfera que se devem à influência humana. A construção de gráficos tipo pizza podem auxiliar na visualização dos dados.
Outro ponto importante para a discussão é a razão pela qual os dados apresentados são na verdade faixas numéricas e não números precisos.
Uma sugestão para essa atividade é a realização de debates em pequenos grupos sobre cada um dos gases, e em seguida uma discussão global, conduzida pelo professor, sobre o papel desses gases no efeito estufa e sobre as possíveis medidas pra diminuir a sua emissão na atmosfera.
Atenção! É importante salientar, como mostram as tabelas, que o ciclo natural da vida terrestre é responsável por boa parte da produção desses gases, e dentro das condições naturais a presença desses gases na atmosfera e do efeito estufa é primordial para a existência da vida no globo terrestre. Sem a presença desses gases a temperatura na Terra variaria muito durante o dia (altas temperaturas de dia e baixas a noite), tornando inviável o desenvolvimento da vida. Nossa preocupação deve estar voltada ao efeito da atividade no aumento descontrolado e contínuo das concentrações desses gases e nos efeitos que esses aumento trará (traz) para o ecossistema terrestre.
| Principais Fontes | Produção Anual (Tg de N2O) |
|---|---|
| Oceanos | 2,2 - 4,1 |
| Solo (Florestas Tropicais) | 3,5 - 5,8 |
| Solo (Florestas Temperadas) | 1,1 - 2,4 |
| Queima de Combustíveis | 0,2 - 0,3 |
| Queima de Biomassa | 0,3 |
| Fertilizantes | 0,02 - 3,5 |
| Total | 7,2 - 16,5 |
| Principais Fontes | Produção Anual (Tg de CO) |
| Fontes Tecnológicas | 440 - 840 |
| Queima de Biomassa | 400 - 1600 |
| Vegetação | 50 - 100 |
| Oceanos | 10 - 190 |
| Oxidação de Metano na Atmosfera | 300 - 900 |
| Oxidação
de Hidrocarbonetos
Naturais na Atmosfera |
400 - 1400 |
| Solos | 2 - 32 |
| Total | 1600 - 5000 |
Hidrocarbonetos naturais são constituídos principalmente de uma classe de compostos conhecida como terpenos. Terpenos evaporam de árvores e outras plantas, como o mentol e a cânfora, geralmente possuem odores agradáveis.
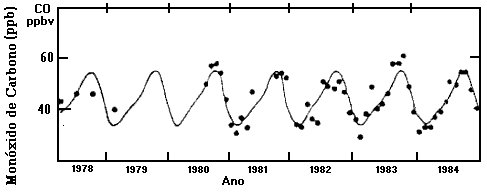
O gráfico abaixo mostra a concentração
de CO na atmosfera na Tasmânia, Austrália. Perceba que a concentração
de CO na atmosfera varia durante o ano. Você pode discutir o porquê
dessas variações.
| Principais Fontes | Produção Anual (Tg de CH4) |
| Pântanos ou Mangues | 100 - 200 |
| Plantações de Arroz | 20 - 150 |
| Fermentação Entétrica (ruminantes) | 65 -100 |
| Perfuração e Transporte
de Gás de Petróleo |
25 -50 |
| Queima de Biomassa | 20 - 80 |
| Termitas | 10 - 50 |
| Terras Costeiras | 20 - 70 |
| Mineração de Carvão | 17 - 50 |
| Oceanos | 5 - 20 |
| Água Potável | 1 - 25 |
| Total | 400 - 600 |
O SO2 é rapidamente oxidado
a SO3 (trióxido de enxofre) na atmosfera, em reações
com radicais hidroxílicos (CA-8)
ou peróxido de hidrogênio (H2O2). Tanto
o SO2 quanto o SO3 são muito solúveis
em água, formando respectivamente o ácido sulfuroso e o ácido
sulfúrico, como indicam as reações abaixo:
O dióxido
de nitrogênio também é formado nas combustões
de carvão e derivados do petróleo. As altas temperaturas
e pressão dos motores à explosão favorecem a reação
entre o N2 e o O2 presentes na atmosfera, formando
o óxido nítrico (NO). O NO reage prontamente, com o O2
do ar, formando o NO2. O NO2 dimeriza formando o
N2O4, que é solúvel em
água, produzindo os ácidos nitroso e nítrico, as reações
estào representadas a seguir:
A reação desses óxidos com água é um dos principais responsáveis pelo fenômeno chamado chuva ácida. A maior acidez na água da chuva causa diversos danos ao ambiente, como o empobrecimento do solo para a agricultura, e um maior desgastes das construções.
Essa página foi produzida
por Rodrigo Marchiori Liegel, aluno do curso Práticas de Ensino
em Química I, 1o
semestre 1997.
| Volta CA-7 | Volta para Index |
| FEUSP
Universidade de S.Paulo |