Essa pilha ou célula eletroquímica
baseia-se na seguinte reação de oxi-redução:
|
Zn + CuSO4
|
|
ZnSO4 + Cu |
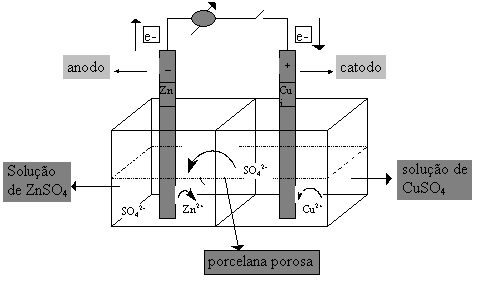
A montagem esquemática da pilha
de Daniell é a seguinte:

- No compartimento da esquerda (meia-célula do zinco), existe uma chapa de zinco mergulhada em solução aquosa de sulfato de zinco (ZnSO4); considerando-se que o zinco, neste caso, tem uma tendência espontânea para perder elétrons, temos: Zn ® Zn2+ + 2e- (é a semi-reação de oxidação); Desse modo, a chapa de zinco "solta" elétrons para o circuito externo (dizemos, então, que a chapa de zinco é o eletrodo negativo ou anodo).
-No compartimento da direita (meia-célula do cobre), existe uma chapa de cobre mergulhada em solução aquosa de sulfato cúprico (CuSO4); considerando-se que o Cu2+, neste caso, tem uma tendência espontânea para receber elétrons, temos:
Cu2+ + 2e- ®
Cu ( é a semi-reação de redução); desse
modo o Cu2+ "captura" elétrons do circuito externo, através
da chapa de cobre, que se torna positiva (dizemos, então, que a
chapa de cobre é o eletrodo positivo ou catodo );
veja tambén que a soma das duas equações anteriores
nos fornece a equação geral da pilha:
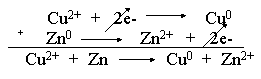
A porcelana porosa deve impedir a mistura das duas soluções, mas deve permitir a passagem dos íons que estão sendo atraídos ou repelidos pelas forças elétricas.
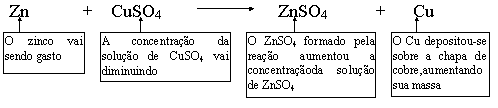
Após certo tempo de funcionamento
da pilha, notamos que a chapa de zinco está corroída, a chapa
de cobre aumentou devido à deposição de cobre e as
concentrações das soluções se alteraram. Tudo
isso é consequência da própria reação
geral de funcionamento da pilha:
Convencionou-se representar a pilha de Daniell (e as demais pilhas) esquematicamente da seguinte maneira:
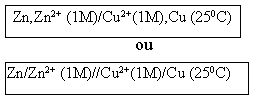
Onde, estão indicados os eletrodos, as molaridades das soluções e a temperatura de funcionamento da pilha.
Resumindo, podemos dizer que a pilha ou
a célula eletroquímica é um dispositivo que transforma
energia química em energia elétrica. Isso é conseguido,
por meio de uma reação de oxi-redução, com
o oxidante e o redutor separados em compartimentos diferentes, de modo
que o redutor "entrega" elétrons ao oxidante através de um
circuito externo (fio).