De acordo com o Princípio da Conservação da Energia, esta não pode ser criada, nem destruída, apenas transformada.
Suponha as seguintes transformações:

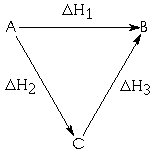
A transformação do reagente A em produto B pode ocorrer por dois caminhos:
Como a energia não pode ser criada nem destruída, então: D H1 = D H2 + D H3
Caso esta igualdade não se verifique, teríamos perdido ou ganho energia, contrariando o Princípio da Conservação.
Em decorrência do Princípio da Conservação de Energia, a Lei de Hess diz que:
| "A variação de entalpia de uma reação química depende apenas dos estados inicial e final do sistema, não importando etapas intermediárias pelas quais a transformação química passou". |
Em outras palavras, se uma transformação química ocorre em várias etapas, o D H da reação será igual à soma das variações de entalpia das diversas etapas.
Como conseqüência podemos somar duas ou mais equações termoquímicas e o D H da equação resultante será igual à soma dos DH das equações adicionadas.
A Lei de Hess constitui uma "ferramenta" poderosa para o cálculo da variação de entalpia de reações que não podem ser determinadas experimentalmente.
O processo para a resolução consiste em trabalhar convenientemente com as equações fornecidas de modo que, de sua soma algébrica, resulta na equação principal, possibilitando o cálculo do D H.
Além disso, devemos lembrar que:
Exemplo: O calor de formação do metano, CH4, não pode ser determinado por medidas calorimétricas pois a reação é lenta e apresenta reações secundárias.
A partir das seguintes equações
I. C(grafite) + O2(g) ® CO2(g) D H = - 94,05 kcal
II. H2(g) + ½ O2(g) ® H2O(l) D H = - 68,32 kcal
III. CH4(g) + 2 O2(g) ® CO2(g) + 2 H2O(l) D H = - 212,87 kcal
pode-se determinar a variação da entalpia da reação de formação do metano:
C(grafite) + 2 H2(g) ® CH4(g) D H = ?
As seguintes operações devem ser feitas:
Assim,
C(grafite) + O2(g) ® CO2(g) D H = - 94,05 kcal
H2(g) + ½ O2(g) ® H2O(l) D H = 2.(- 68,32) kcal
CO2(g) + 2 H2O(l) ® CH4(g) + 2 O2(g) D H = + 212,87 kcal
C(grafite) + 2 H2(g) ® CH4(g) D H = - 17,82 kcal