|
PROTEÍNAS
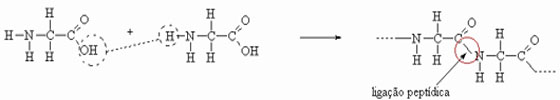
As proteínas são compostos orgânicos de estrutura complexa e massa molecular elevada (entre 15.000 e 20.000.000) e são sintetizadas pelos organismos vivos através da condensação de um número grande de moléculas de a -aminoácidos, através de ligações denominadas ligações peptídicas. Essa estrutura foi esclarecida pelo cientista Emil Fischer. Veja :
Assim, temos :
Evidentemente, as proteínas, por hidrólise, originam uma mistura de a a -aminoácidos. Assim, aquecendo uma proteína (por exemplo a albumina existente do ovo), durante um tempo prolongado (24h), na presença de ácido ou base fortes diluídos, ela se desdobra em seus a a -aminoácidos. As proteínas são substâncias sólidas, incolores, insolúveis em solventes orgânicos, algumas são solúveis em água, enquanto outras são solúveis ou em soluções aquosas diluídas de sais, ou em soluções aquosas de ácidos, ou em soluções aquosas de bases, produzindo sempre colóides. Elas são essenciais para o funcionamento das células vivas e, juntamente com os glicídios e lipídios, constituem a alimentação básica dos animais. No organismo humano, durante a digestão, elas se hidrolisam catalíticamente no estômago sob a ação da pepsina (suco gástrico) e da tripsina (suco pancreático) e no intestino (duodeno) sob a ação da erepsina. São muitas as fontes de proteínas e o número desses polipeptídeos existentes na natureza é praticamente infinito, embora o número de a -aminoácidos seja de apenas cerca de 25. Classificamos as proteínas em :
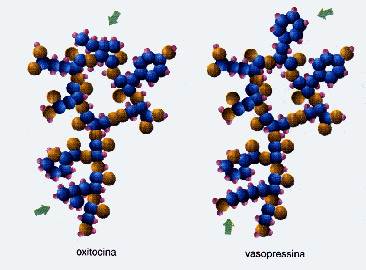
Com relação à estrutura das proteínas, temos que considerar três aspectos : estrutura primária, estrutura secundária e estrutura terciária. A estrutura primária se refere à seqüência de resíduos dos aminoácidos no polipeptídeo. Uma variação na seqüência conduz a uma proteína diferente, com ação bioquímica diferente. Assim, por exemplo, embora a oxitocina e a vasopressina (miniproteínas) difiram entre si na sequência de apenas dois aminoácidos, a oxitocina provoca as contrações uterinas enquanto a vasopressina provoca um aumento da pressão sangüínea.
|
||
|
|
|||
|
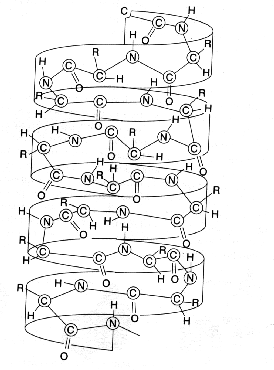
O cientista Linus Pauling e seus colaboradores
deduziram, em 1951 – de acordo com diagramas de difração de raios X obtidos de proteínas cristalizadas – que algumas
proteínas têm uma estrutura secundária de forma helicoidal, devido às pontes de
hidrogênio estabelecidas intramolecularmente. Isso ocorre, por exemplo, com as proteínas
fibrosas que são longos polipeptídeos filiformes, dispostos em capas unidas por pontes
de hidrogênio, formando fibras insolúveis em água. Dentre as proteínas fibrosas,
podemos citar a queratina (cabelo, unha, chifre, casco, penas) e a miosina (músculos)
Figura 2 – Estrutura secundária das proteínas.
Estudos de algumas proteínas mostram que deve existir uma estrutura terciária bastante complexa, em que as cadeias de polipeptídeos se enrolam ao redor de si mesmas. Assim, por exemplo, os cientistas Kendrew e Perutz, da Universidade de Cambridge (Inglaterra), deduziram a estrutura terciária da hemoglobina. Veja :
A orientação espacial é vital para a função bioquímica de uma proteína. Como as pontes de hidrogênio são ligações fracas, um aquecimento pode provocar o rompimento dessas ligações, assim as estruturas secundária e terciária se desfazem e com isso, a proteína perde a sua ação biológica. Esse fenômeno, geralmente irreversível, é conhecido por desnaturação, que você pode perceber facilmente aquecendo um ovo : antes do aquecimento ele é solúvel em água; após o aquecimento ele se torna insolúvel na água.
|