Vimos anteriormente que há reações que liberam calor e reações que absorvem calor. De acordo com a Lei da Conservação de Energia, esta não pode ser criada nem destruída, apenas transformada de uma forma para outra.
Em reações de combustão ocorre liberação de energia na forma de calor. Mas, de onde veio essa energia?
A resposta pode ser a seguinte: todas as substâncias possuem uma determinada quantidade de energia; nas combustões, a energia dos reagentes é maior que a dos produtos, logo, parte dessa energia é liberada.
Ao contrário, se os produtos tiverem energia maior que a dos reagentes, houve fornecimento de energia (reação endotérmica).
Para a energia armazenada nas substâncias (reagentes e produtos) damos o nome de entalpia (H). Mais tarde veremos que a entalpia de uma substância decorre das ligações entre os átomos, íons ou moléculas.
Numa reação, a diferença entre as entalpias dos produtos e a dos reagentes é definida como variação de entalpia (D H):
em que Hp = soma
das entalpias dos produtos
Hr = soma das
entalpias dos reagentes
Quando uma transformação se realiza a pressão constante, o calor liberado numa reação exotérmica ou o calor absorvido numa reação endotérmica é igual à variação de entalpia:
Diagramas Termoquímicos
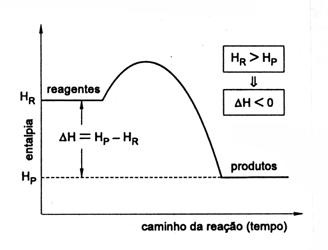
Reações exotérmicas
Nas transformações exotérmicas a entalpia dos reagentes é maior que a dos produtos, havendo liberação de energia.
Como Hr > Hp temos que D H = Hp - Hr Þ D H < 0. O calor de reação é negativo, indicando a saída de calor do sistema. Esta situação é representada graficamente a seguir:

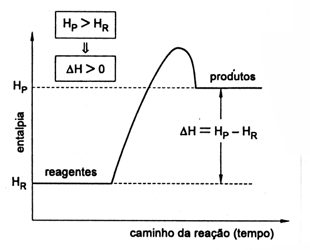
Reações endotérmicas
Nas transformações endotérmicas a entalpia dos reagentes é menor que a dos produtos, tendo ocorrido absorção de energia. Como Hr < Hp temos que D H > 0. O calor de reação é positivo, indicando a entrada de calor ao sistema. Esta situação é representada graficamente a seguir:
Equações termoquímicas
A equação termoquímica representa a transformação química realizada, a energia envolvida, as condições de pressão e temperatura e os estados físicos de reagentes e produtos.
Exemplos:
1o.) HCl(aq) + NaOH(aq) ® NaCl(aq) + H2O(l) D H = -13,8 kcal a 25° C e 1 atm.
Segundo a equação, a reação entre 1 mol de ácido clorídrico em solução aquosa com 1 mol de hidróxido de sódio em solução aquosa produz 1 mol de cloreto de sódio aquoso e 1 mol de água líquida. A 25° C e 1 atm, a variação de entalpia é igual a - 13,8 kcal (houve liberação de 13,8 kcal de calor).
2o.) 2NH3(g) ® N2(g) + 3H2(g) D H = + 92,2 kJ a 25° C e 1 atm.
Neste caso, a 25° C e
1 atm, a decomposição de 2 mols de amônia gasosa em
1 mol de gás nitrogênio e 3 mols de gás hidrogênio
absorve 92,2 kJ de calor.
Estado Padrão da Termoquímica
O calor envolvido numa reação química depende de vários fatores: temperatura, pressão, estado físico e variedade alotrópica de reagentes e produtos, etc.
Assim, a escolha de um conjunto de condições padronizadas serve para evitar a necessidade de ter sempre que especificar as condições para as quais as entalpias estão registradas e permitir comparações entre os calores de reação de diversas transformações.
| temperatura | 25° C ou 298 K |
| pressão | 1 atm |
Caso a reação ocorra em outras condições, o calor desenvolvido seria diferente.
Muitas vezes, as condições não são citadas. Neste caso, fica subentendido que as condições do estado padrão são obedecidas. Porém, se alguma condição for diferente da padrão, torna-se obrigatório citá-lo.