1) (VUNESP) Quando
a massa de 1,25 g de Fe reage com enxofre para formar FeS sólido,
há liberação de 2,24 kJ, na forma de calor.
Escreva a equação
para a reação de 1 mol de Fe, indicando a quantidade de calor
liberado, segundo as convenções termoquímicas.
Dados: massas molares, em g/mol, Fe = 56, S = 32.
Resolução
Cálculo da quantidade de calor liberada, por mol
1,25 g Fe ----- 2,24 kJ
(1 mol) 56 g Fe ----- x kJ
x = 100,35 kJ/mol Fe
Equação
termoquímica balanceada da reação entre ferro e enxofre:
Fe(s) + S(s) ®
FeS(s) D H = - 100,35 kJ/mol Fe
Exercícios propostos
1) (FCC) A queima
completa do carbono é uma reação exotérmica.
Assim, considerando-se as energias (E) armazenadas nos reagentes e produto,
pode-se afirmar que:
(a)
E (C) = E (O2) = E (CO2)
(b)
E (C) + E (O2) = E (CO2)
(c)
E (C) + E (O2) > E (CO2)
(d)
E (C) + E (O2) < E (CO2)
(e)
E (C) + E (O2) + E (CO2) = 0
2) (Mack)
Observando-se os dados a seguir, pode-se dizer que o reagente apresenta
menor energia que o produto somente em:
I. ½ Cl2(g) ®
Cl(g) D H = + 30,0 kcal/mol de Cl
II. C(d) ®
C(g) D H = - 0,5 kcal/mol de C
III. H2O(g) ®
H2O(l) D H = - 9,5 kcal/mol
de H2O
| a) II | b) III | c) III e II | d) III e I | e) I |
3) (PUC) Relativamente à reação dada pela equação: CaCO3 ® CaO + CO2 D H = + 42 kcal/mol pedem-se:
a) indicar o sentido da troca
de calor entre sistema e vizinhanças;
b) calcular a quantidade
de calor trocada por um sistema no qual são obtidos 224 g de óxido
de cálcio.
4) (FAAP) A combustão da grafite é representada por: C(grafite) + O2(g) ® CO2(g) D H = -94 kcal/mol A energia térmica requerida para dissociar 88 g de gás carbônico em carbono grafite e oxigênio, em kcal é:
| a) 44 | b) 66 | c) 94 | d) 188 | e) -94 |

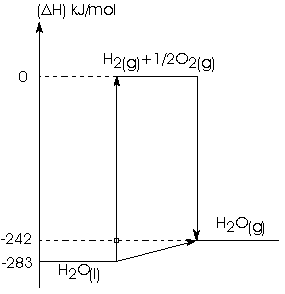
Assinale a opção que contém a equação termoquímica correta:
(a) H2(g)
+ ½ O2(g) ® H2O(g)
D H = + 242 kJ.mol-1
(b) H2O(l)
® H2O(g) D
H = - 41 kJ.mol-1
(c) H2O(l)
® H2(g) + ½ O2(g)
D H = + 283 kJ.mol-1
(d) H2O(g)
® H2(g) + ½ O2(g)
D H = 0 kJ.mol-1
(e) H2(g)
+ ½ O2(g) ® H2O(l)
D H = + 41 kJ.mol-1
6) (Fuvest) Na reação representada por CH4(g) + 4 Cl2(g) ® CCl4(l) + 4 HCl(g) há liberação de 108 kJ de energia térmica por mol de HCl(g) formado. Nas mesmas condições, qual será a energia térmica liberada na formação de 73,0 g de HCl(g) (Dados: massas atômicas: H = 1,0; Cl = 35,5)?
| a) 54 kJ | b) 108 kJ | c) 162 kJ | d) 216 kJ | e) 432 kJ |
8) (Unicamp) Uma vela
é feita de um material ao qual se pode atribuir a fórmula
C20H42. Qual o calor liberado na combustão
de 10,0 g dessa vela a pressão constante?
(Dados: C20H42(s)
+ 61/2 O2(g) ® 20 CO2(g)
+ 21 H2O(g); D H = - 13.300
kJ/mol.)
9) (Fuvest)
Qual é a energia envolvida na obtenção de 10 g de
cobre metálico através da reação entre uma
solução de sal de cobre e zinco? O processo libera ou absorve
energia?
(Dados: Zn0
+ Cu 2+ ® Cu0 + Zn2+
D H = - 223 kJ/mol; massa molar do cobre = 63,5
g/mol)
10) (Unicamp) Em alguns fogos de artifício, alumínio metálico em pó é queimado, liberando luz e calor. Esse fenômeno pode ser representado como: 2 Al (s) + 3/2 O2 (g) ® Al2O3(s) D H = - 1.653 kJ/mol
a) Qual o volume de O2,
nas condições normais de temperatura e pressão, necessário
para reagir com 1,0 g do metal?
b) Qual a quantidade de
calor à pressão constante desprendida na reação
de 1,0 g de alumínio?
Volume molar do gás ideal nas condições normais de temperatura e pressão = 22,4 L. (Dados: massa atômica relativa do alumínio = 27.)